有很多患者到院就医,被告知可以参加临床试验,患者第一反应:啥?拿我做实验,那不是当“小白鼠”吗?其实事实并非如此,今天我们就来认真聊一聊“临床试验”的相关问题!
什么是临床试验(GCP)?
临床试验(GCP)是一种前瞻性试验研究,指在人为条件控制下,以特定人群为受试对象(患者或健康志愿者),以发现和证实干预措施(药品、特殊检查、特殊治疗手段)对特定疾病的防治、诊断的有效性(包括药品的作用、吸收、分布、代谢、排泄)和安全性(不良反应)。
通俗解释就是:一个新药正式上市前,征得受试者同意后,医生通过观察受试者使用这个新药,来看这个药的疗效和副作用。
为什么要进行临床试验呢?
临床试验是确保药物和治疗方法安全、有效和适用的关键步骤,对于医学领域的进步具有重要意义。我国药品监督管理局2003年9月1日起正式实施《药品试验管理规范》规定所有需要上市售卖的药物都必须通过相关部分的监管下进行临床试验,研究者从试验的结果分析得到药物的安全性、有效性、适用时机及适用人群,只有所有结果是肯定、有效、安全的才能向国家申请试验药物的上市,患者才能买得到,同时在研究的过程中能够推动医学领域的知识发展,为未来的研究和创新奠定基础。
参加进入临床试验,就成了那只“小白鼠”吗?
其实开展临床试验是对患者利益的保护。《赫尔辛基宣言》,规定了人体试验必须遵循的原则与规范,力求受试者最大程度受益和尽可能避免伤害。
那所谓的“小白鼠”到底出现在哪?我们国家在相关法规中规定:需要把新药在细胞和小白鼠身上试验,取得成功后,还要由国家药品监督部门和独立的伦理委员会审批,看是否符合临床试验规范,才可以进入I、II、III期研究和上市后的IV期试验阶段。所以,临床试验是既严格又复杂的,“小白鼠”是在最前面的,一系列审批成功后,受试者才有机会使用新药。所以,你一定不是“小白鼠”!
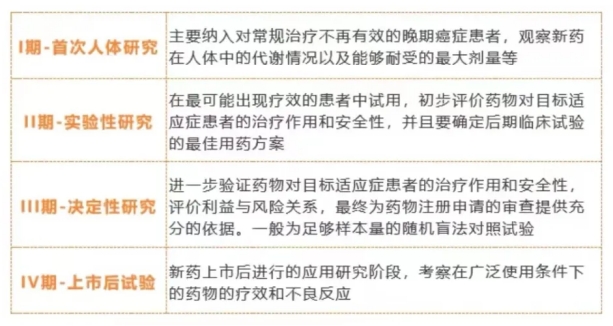
以抗肿瘤药物为例用下图来说明I、II、III、IV期临床试验的目的:
参加临床试验的优势及受试者获得的权益
法律保护
国家制定了明确制度流程来规范临床试验。首先每个药物临床试验是要在国家食品药品监督管理局(CDE)备案。其次研究者须向伦理委员会提交研究报告,只有伦理委员会同意后,试验才可以开始。以上措施对临床试验的风险进行有效把控,从而保障受试者权益。
权威保障
开展医院必须是通过了国家药监局核查并获批《临床试验资格认定证书》,研究医生一般为各领域、各参研医院的权威专家。
前沿治疗
为受试者提供目前市面不可及的最前沿新药抗肿瘤治疗的机会。
免费治疗及补贴
参加临床试验可以免费提供的检查费、治疗药物费等,另外并额外提供受试者来院的交通补贴以及采血补贴等。
知情同意
受试者参加试验前,研究医生须向受试者说明试验可能的受益和风险、可供选用的其他治疗方法、权利和义务等,使受试者充分了解并获得其同意,试验过程中受试者有权随时退出试验且不受任何歧视。

所以经过以上大篇幅的介绍,相信你了解医生邀你参加临床试验的真正意义——
你不是那只“小白鼠”
你当不了那只“小白鼠”!
精心设计、严谨操作的临床试验是提高人类健康,寻找新的治疗手段的最快也是最安全的途径。
供稿
肿瘤三科(甲状乳腺科)王绪娟
编辑
宣传统战科朱锦悦

